აქვს თუ არა ჟანგბადს სითბო და ელექტროგამტარობა? ჟანგბადის, ძმარმჟავას და ალუმინის თვისებები
ქიმიურად მარტივი ნივთიერება, რომელსაც აქვს ბზინვარება, ელასტიურობა, თერმული და ელექტრული გამტარობა
ალტერნატიული აღწერილობებიმოქნილი ნივთიერება მაღალი ელექტრული და თბოგამტარობით
ქიმიურად მარტივი ნივთიერება ბზინვარებით, ელასტიურობით, თერმული და ელექტრული გამტარობით
ჩინური რწმენის 5 ელემენტიდან ერთ-ერთი
. "ხალხი კვდება..." (მეფისტოფელი)
. "ხალხი კვდება..." (არია)
. "გამძლე მასალა", რომელიც შეიძლება შეიცავდეს ხმას
ჩინეთის რწმენის 5 ელემენტიდან 1
კარგი ელასტიურობის, თერმული და ელექტრული გამტარობის მქონე ნივთიერება
ძვირფასი...
ჯგუფ "აეროსმიტის" რკინის მუსიკა
კოროზიის მსხვერპლი
სპილენძიც და ოქროც
და სპილენძი, ნატრიუმი და ვერცხლისწყალი
და სპილენძი, კალა, რკინა და ოქრო
მოქნილი ელექტროგამტარი ნივთიერება
ხალხი კვდება მისთვის
სპილენძი ან ტიტანი
ლითონის მ.ლათ. კრუშეცკი; ხოლო მცირე სახით, დნობისას: კინგლეტი. ყოველდღიური ცხოვრება, ძვირფასი, ძვირადღირებული ლითონები: ოქრო, პლატინა, ვერცხლი; მარტივი: რკინა, სპილენძი, თუთია, კალა, ტყვია; ქიმიამ აღმოაჩინა ასეთი პრინციპები თითქმის ყველა ნამარხზე, რომელიც შედგება ოქსიდებისა და კიტრის მარილებისგან; საერთო ჯამში, ამ თვალსაზრისით, ორმოცზე მეტი ლითონია. მეტალიკი, -პირადი, -პირადი, მასთან დაკავშირებული. ლითონის სარკე. - ბრწყინავს, რეკავს. ლითონი, დაქუცმაცებული ლითონისგან. მეტალოიდი არის ნახევრადმეტალი, ნამარხი, რომელიც ლითონების მსგავსია, მაგრამ მათი ზოგიერთი თვისების გარეშე: ბზინვარება, ელასტიურობა, სითბოს გამტარობა. გოგირდი, ფოსფორი და ბორაქსი ითვლება მეტალოიდებად. -იდნი, -იდე, მასთან დაკავშირებული. მეტალიკი, მეტალის მსგავსი, დამსხვრევის მსგავსი. -მზიდი ფენა, მადნის შემცველი, სამთო, -გლუვი, -დნობა, დაკავშირებული დამტვრევის დნობასთან. -მოჩუქურთმებული, -ნახერხი, მონათესავე. ლითონების ჭრისთვის. - გაპარსვა, - დაფანცვა, ნაფოტებთან დაკავშირებული, დალაგება. მეტალურგია სამთო ხელოვნებისა და ქიმიის ნაწილი: მეცნიერება ლითონების მოპოვების, გადამუშავებისა და დამუშავების შესახებ. -გიკური, -ტექნიკური, დაკავშირებული მეცნიერებასთან, ხელოვნებასთან. მეტალურგი, რომელიც ამ მეცნიერებას ეწევა. მეტალოგრაფია, ლითონების აღწერა
ნატრიუმი ან რკინა
ნიკელი - ფერადი...
მარტივი ნივთიერება
მერკური, როგორც ქიმიური ნივთიერება
მერკური, რკინა
ტიტანი, ოქრო, ალუმინი ან სპილენძი
ქიმიურად მარტივი ნივთიერება
ქიმიურად მარტივი ნივთიერება განსაკუთრებული ბზინვარებით, კარგი თერმული და ელექტრული გამტარობით
სპილენძისა და რკინის ქიმიური მდგომარეობა
შავი, ფერადი და კეთილშობილი
რა არის სპილენძი
რა არის ვერცხლისწყალი
რა იზიდავს მაგნიტს
ეს სიტყვა მომდინარეობს ბერძნულიდან, რაც ნიშნავს "ჩემს, ჩემსას"
. "გამძლე მასალა", რომელიც შეიძლება შეიცავდეს ხმას
ეს სიტყვა მომდინარეობს ბერძნულიდან, რაც ნიშნავს "ჩემს, ჩემსას"
რას იზიდავს მაგნიტი?
რა არის ვერცხლისწყალი?
რა არის სპილენძი?
Aerosmith ჯგუფის რკინის მუსიკა
. "ხალხი კვდება ..." (მეფისტოფელი)
. "ხალხი კვდება..." (არია)
რას ჭრით ჩიზლით?
თქვენ იწყებთ ახალი აკადემიური საგნის - ქიმიის გაცნობას. რას სწავლობს ქიმია?
როგორც იცით თქვენი ფიზიკის კურსიდან, ბევრი ნივთიერება შედგება მოლეკულებისგან, მოლეკულები კი ატომებისგან. ატომები იმდენად მცირეა, რომ მათგან მრავალი მილიარდი შეიძლება მოთავსდეს ნემსის წვერზე. თუმცა, არსებობს მხოლოდ 114 ტიპის ატომები.
ისეთი ნივთიერებები, როგორიცაა ნეონი, არგონი, კრიპტონი და ჰელიუმი, შედგება ცალკეული იზოლირებული ატომებისგან. მათ ასევე უწოდებენ კეთილშობილ ან ინერტულ აირებს, რადგან მათი ატომები არ ერწყმის ერთმანეთს და თითქმის არ ერწყმის სხვა ქიმიური ელემენტების ატომებს. წყალბადის ატომები სრულიად განსხვავებული საკითხია. ისინი შეიძლება არსებობდნენ მარტო (ნახ. 4, ა), როგორც მზეზე, რომლის ნახევარზე მეტი შედგება წყალბადის ცალკეული ატომებისგან. მათ შეუძლიათ გაერთიანდნენ ორი ატომის მოლეკულებად (ნახ. 4, ბ), შექმნან ყველაზე მსუბუქი გაზის მოლეკულები, რომელსაც ქიმიური ელემენტის მსგავსად წყალბადი ეწოდება. წყალბადის ატომები ასევე შეიძლება გაერთიანდეს სხვა ქიმიური ელემენტების ატომებთან. მაგალითად, წყალბადის ორი ატომი, ერთ ჟანგბადის ატომთან შერწყმით (ნახ. 4, გ) ქმნის თქვენთვის კარგად ნაცნობ ნივთიერების - წყლის მოლეკულებს.

ბრინჯი. 4.
ქიმიური ელემენტის წყალბადის არსებობის ფორმები:
a - წყალბადის ატომები; ბ - წყალბადის მოლეკულები; გ - წყალბადის ატომები წყლის მოლეკულაში
ანალოგიურად, "ქიმიური ელემენტის ჟანგბადის" კონცეფცია აერთიანებს იზოლირებულ ჟანგბადის ატომებს, ჟანგბადს - მარტივ ნივთიერებას, რომლის მოლეკულები შედგება ჟანგბადის ორი ატომისგან და ჟანგბადის ატომებისგან, რომლებიც რთული ნივთიერებების ნაწილია. ამრიგად, ნახშირორჟანგის მოლეკულები შეიცავს ჟანგბადს და ნახშირბადის ატომებს, ხოლო შაქრის მოლეკულები შეიცავს ნახშირბადის, წყალბადის და ჟანგბადის ატომებს.
აქედან გამომდინარე, თითოეული ქიმიური ელემენტი არსებობს სამი ფორმით: თავისუფალი ატომები, მარტივი ნივთიერებები და რთული ნივთიერებები (იხ. სურ. 4).
"ქიმიური ელემენტის" ცნება უფრო ფართოა და არ უნდა აგვერიოს "მარტივი ნივთიერების" კონცეფციასთან, განსაკუთრებით თუ მათი სახელები იგივეა. მაგალითად, როცა ამბობენ, რომ წყალი შეიცავს წყალბადს, გულისხმობენ ქიმიურ ელემენტს, ხოლო როცა ამბობენ, რომ წყალბადი ეკოლოგიურად სუფთა ტიპის საწვავია, უბრალო ნივთიერებას გულისხმობენ.
სხვადასხვა ნივთიერებები ერთმანეთისგან განსხვავდება მათი თვისებებით. წყალბადი არის აირი, ძალიან მსუბუქი, უფერო, უსუნო, უგემოვნო, აქვს 0,00009 გ/სმ 3 სიმკვრივე, დუღს -253 °C ტემპერატურაზე და დნება -259 °C ტემპერატურაზე და ა.შ. ნივთიერებებს ფიზიკურს უწოდებენ.
თქვენ შეგიძლიათ აღწეროთ ნივთიერების ფიზიკური თვისებები შემდეგი გეგმის გამოყენებით:
- აგრეგაციის რა მდგომარეობაშია (აირიანი, თხევადი, მყარი) ნივთიერება მოცემულ პირობებში?
- რა ფერის არის ნივთიერება? აქვს ბრწყინავს?
- აქვს თუ არა ნივთიერებას სუნი?
- რა არის ნივთიერების სიხისტე ფარდობითი სიხისტის სკალაზე (მოჰსის სკალა) (ნახ. 5)? (იხილეთ საცნობარო წიგნები.)

ბრინჯი. 5.
სიხისტის მასშტაბი
- ავლენს თუ არა ნივთიერება პლასტიურობას, მტვრევადობას ან ელასტიურობას?
- იხსნება თუ არა ნივთიერება წყალში?
- რა არის ნივთიერების დნობის წერტილი და დუღილის წერტილი? (იხილეთ საცნობარო წიგნები.)
- რა არის ნივთიერების სიმკვრივე? (იხილეთ საცნობარო წიგნები.)
- აქვს თუ არა ნივთიერებას თერმული და ელექტრული გამტარობა? (იხილეთ საცნობარო წიგნები.)
ლაბორატორიული ექსპერიმენტი No1
კრისტალური მყარი და ხსნარების თვისებების შედარება
შეადარე გვ.-ზე მოცემულის გამოყენებით. გეგმა 10, თასებში მოცემული ნივთიერებების ნიმუშების თვისებები:
- ვარიანტი 1 - კრისტალური შაქარი და სუფრის მარილი;
- ვარიანტი 2 - გლუკოზა და ლიმონმჟავა.
იცის ნივთიერებების თვისებები, ადამიანს შეუძლია გამოიყენოს ისინი უფრო დიდი სარგებლობისთვის. მაგალითად, განვიხილოთ ალუმინის თვისებები და გამოყენება (ნახ. 6).

ბრინჯი. 6.
ალუმინის გამოყენება:
1 - თვითმფრინავების წარმოება; 2 - სარაკეტო მეცნიერება; 3 - ელექტროგადამცემი ხაზების წარმოება; 4 - ჭურჭლის, დანაჩანგლისა და შესაფუთი ფოლგის წარმოება
მისი სიმსუბუქისა და სიმტკიცის გამო, ალუმინი და მისი შენადნობები გამოიყენება თვითმფრინავებისა და რაკეტების წარმოებაში; არ არის მიზეზი, რომ ალუმინს უწოდებენ "ფრთიან ლითონს".
ალუმინის სიმსუბუქე და კარგი ელექტროგამტარობა გამოიყენება ელექტროსადენების წარმოებაში ელექტროგადამცემი ხაზებისთვის (ელექტრო ხაზები).
თბოგამტარობა და არატოქსიკურობა მნიშვნელოვანია ალუმინის ჭურჭლის წარმოებაში.
არატოქსიკურობა და პლასტიურობა შესაძლებელს ხდის ფართოდ გამოიყენოს ალუმინის თხელი ფურცლები - ფოლგა - როგორც შესაფუთი მასალა შოკოლადის ფილების, ჩაის, მარგარინის, რძის, წვენების, სხვა პროდუქტების, აგრეთვე კონტურულ უჯრედებში მოთავსებული მედიკამენტებისთვის.
მშენებლობაში ალუმინის შენადნობების დანერგვა ზრდის სტრუქტურების გამძლეობას და საიმედოობას.
ეს მაგალითები გვიჩვენებს, რომ სხვადასხვა ფიზიკური სხეულები შეიძლება დამზადდეს ერთი ნივთიერებისგან (ალუმინისგან).
ალუმინს შეუძლია დაწვა კაშკაშა ალით (სურ. 7), ამიტომ მას იყენებენ ფერად ფოიერვერკებში და შუშხუნების დასამზადებლად (გაიხსენეთ ნ. ნოსოვის მოთხრობა "შუშხუნები"). წვისას ალუმინი იქცევა სხვა ნივთიერებად - ალუმინის ოქსიდად.

ბრინჯი. 7.
ალუმინის წვა არის ნაპერწკლების და ფეიერვერკების საფუძველი
საკვანძო სიტყვები და ფრაზები
- ქიმიის საგანი.
- ნივთიერებები მარტივი და რთულია.
- ნივთიერებების თვისებები.
- ქიმიური ელემენტი და მისი არსებობის ფორმები: თავისუფალი ატომები, მარტივი ნივთიერებები და რთული ნივთიერებები ან ნაერთები.
კომპიუტერთან მუშაობა
- მიმართეთ ელექტრონულ აპლიკაციას. შეისწავლეთ გაკვეთილის მასალა და შეასრულეთ დავალებული დავალებები.
- იპოვეთ ელ.ფოსტის მისამართები ინტერნეტში, რომლებიც შეიძლება გახდეს დამატებითი წყაროები, რომლებიც გამოავლენს აბზაცში საკვანძო სიტყვებისა და ფრაზების შინაარსს. შესთავაზეთ მასწავლებელს თქვენი დახმარება ახალი გაკვეთილის მომზადებაში – მოამზადეთ ანგარიში შემდეგი აბზაცის საკვანძო სიტყვებსა და ფრაზებზე.
კითხვები და ამოცანები
- ფილეო (ბერძნული) ნიშნავს "სიყვარულს", ფობოს - "შიშს". მიეცით განმარტება ტერმინების „ქიმიოფილია“ და „ქიმიოფობია“, რომლებიც ასახავს ადამიანთა ჯგუფების მკვეთრად საპირისპირო დამოკიდებულებას ქიმიის მიმართ. რომელია მართალი? დაასაბუთეთ თქვენი თვალსაზრისი.
- უსასრულო რაოდენობის ჯაშუშური და სხვა დეტექტიური სამუშაოების სავალდებულო ატრიბუტია კალიუმის ციანიდი, უფრო სწორედ, კალიუმის ციანიდი, რომელსაც აქვს ნერვული სისტემის პარალიზების თვისება, რითაც მსხვერპლს მყისიერ სიკვდილამდე მიჰყავს. მიეცით მაგალითები სხვა ნივთიერებების თვისებების შესახებ, რომლებიც გამოიყენება ლიტერატურულ ნაწარმოებებში.
- ცალ-ცალკე ჩამოწერეთ ნივთიერებების და სხეულების სახელები მოცემული სიიდან: სპილენძი, მონეტა, მინა, მინა, ვაზა, კერამიკა, მავთული, ალუმინი. გამოიყენეთ მინიშნება: სხეულის სახელისთვის - არსებითი სახელი - შეგიძლიათ აირჩიოთ ნივთიერების სახელიდან წარმოქმნილი ფარდობითი ზედსართავი სახელი, მაგალითად: რკინა და ლურსმანი - რკინის ლურსმანი.
- ჩამოწერეთ თვისობრივი ზედსართავი სახელები: მსუბუქი, მრგვალი, გრძელი, მძიმე, მძიმე, სუნიანი, ხსნადი, წონიანი, ჩაზნექილი, რბილი, თხევადი, გამჭვირვალე, რომლებიც შეიძლება მივაკუთვნოთ: ა) ნივთიერებებს; ბ) ორგანოებს; გ) როგორც სხეულებს, ასევე ნივთიერებებს.
- შეადარეთ „მარტივი ნივთიერების“ და „რთული ნივთიერების“ ცნებები. იპოვნეთ მსგავსება და განსხვავებები.
- დაადგინეთ, რომელი ნივთიერებები, რომელთა მოლეკულური მოდელები ნაჩვენებია მე-2 სურათზე, კლასიფიცირდება როგორც: ა) მარტივი ნივთიერებები; ბ) რთულ ნივთიერებებზე.
- რომელი ცნებაა უფრო ფართო - „ქიმიური ელემენტი“ თუ „მარტივი ნივთიერება“? მიეცით მტკიცებულებებზე დაფუძნებული პასუხი.
- მიუთითეთ სად მოიხსენიება ჟანგბადი, როგორც ქიმიური ელემენტი და სად - როგორც მარტივი ნივთიერება:
ა) ჟანგბადი წყალში ოდნავ ხსნადია;
ბ) წყლის მოლეკულები შედგება ორი წყალბადის ატომისა და ერთი ჟანგბადის ატომისგან;
გ) ჰაერი შეიცავს 21% ჟანგბადს (მოცულობით);
დ) ჟანგბადი ნახშირორჟანგის ნაწილია.
- მიუთითეთ სად მოიხსენიება წყალბადი, როგორც მარტივი ნივთიერება და სად მოიხსენიება როგორც ქიმიური ელემენტი:
ა) წყალბადი ორგანული ნაერთების უმეტესობის ნაწილია;
ბ) წყალბადი არის ყველაზე მსუბუქი აირი;
გ) ბუშტები ივსება წყალბადით;
დ) მეთანის მოლეკულა შეიცავს წყალბადის ოთხ ატომს.
- განვიხილოთ ნივთიერების თვისებებსა და მის გამოყენებას შორის კავშირი: ა) მინის მაგალითით; ბ) პოლიეთილენი; გ) შაქარი; დ) რკინა.
ვინ იცის წყლის ფორმულა სკოლის დღიდან? რა თქმა უნდა, ეს არის ის. სავარაუდოა, რომ ქიმიის მთელი კურსიდან ბევრმა, ვინც შემდეგ მას სპეციალიზებულად არ სწავლობს, მხოლოდ იცის რას ნიშნავს ფორმულა H 2 O. მაგრამ ახლა ჩვენ შევეცდებით გავიგოთ რაც შეიძლება მეტი დეტალი და სიღრმისეულად. რა არის მისი ძირითადი თვისებები და რატომ არსებობს სიცოცხლე მის გარეშე დედამიწაზე შეუძლებელია.
წყალი, როგორც ნივთიერება
წყლის მოლეკულა, როგორც ვიცით, შედგება ერთი ჟანგბადის და ორი წყალბადის ატომისგან. მისი ფორმულა ასე იწერება: H 2 O. ამ ნივთიერებას შეიძლება ჰქონდეს სამი მდგომარეობა: მყარი - ყინულის სახით, აირისებრი - ორთქლის სახით და თხევადი - როგორც ნივთიერება ფერის, გემოსა და სუნის გარეშე. სხვათა შორის, ეს არის ერთადერთი ნივთიერება პლანეტაზე, რომელიც შეიძლება არსებობდეს სამივე სახელმწიფოში ერთდროულად ბუნებრივ პირობებში. მაგალითად: დედამიწის პოლუსებზე არის ყინული, ოკეანეებში არის წყალი და აორთქლება მზის სხივების ქვეშ არის ორთქლი. ამ თვალსაზრისით წყალი ანომალიურია.
წყალი ასევე არის ყველაზე უხვი ნივთიერება ჩვენს პლანეტაზე. იგი მოიცავს პლანეტა დედამიწის ზედაპირს თითქმის სამოცდაათი პროცენტით - ეს არის ოკეანეები, მრავალი მდინარე ტბებით და მყინვარები. პლანეტაზე წყლის უმეტესი ნაწილი მარილიანია. უვარგისია სასმელად და მეურნეობისთვის. მტკნარი წყალი პლანეტაზე წყლის მთლიანი რაოდენობის მხოლოდ ორნახევარ პროცენტს შეადგენს.
წყალი ძალიან ძლიერი და მაღალი ხარისხის გამხსნელია. ამის წყალობით, წყალში ქიმიური რეაქციები უზარმაზარი სიჩქარით ხდება. იგივე თვისება გავლენას ახდენს ადამიანის ორგანიზმში მეტაბოლიზმზე. რომ ზრდასრული ადამიანის სხეული სამოცდაათი პროცენტით წყალია. ბავშვში ეს პროცენტი კიდევ უფრო მაღალია. სიბერემდე ეს მაჩვენებელი სამოცდაათიდან სამოც პროცენტამდე იკლებს. სხვათა შორის, წყლის ეს თვისება ნათლად მეტყველებს იმაზე, რომ ის არის ადამიანის სიცოცხლის საფუძველი. რაც უფრო მეტი წყალია ორგანიზმში, მით უფრო ჯანსაღი, აქტიური და ახალგაზრდაა. ამიტომაც ყველა ქვეყნის მეცნიერები და ექიმები დაუღალავად ამტკიცებენ, რომ ბევრი დალევა გჭირდებათ. ეს არის წყალი მისი სუფთა სახით და არა ჩაის, ყავის ან სხვა სასმელების შემცვლელი.
წყალი აყალიბებს კლიმატს პლანეტაზე და ეს არ არის გადაჭარბებული. ოკეანის თბილი დინებები მთელ კონტინენტებს ათბობს. ეს ხდება იმის გამო, რომ წყალი შთანთქავს უამრავ მზის სითბოს და შემდეგ ათავისუფლებს მას, როდესაც ის იწყებს გაგრილებას. ასე არეგულირებს ტემპერატურას პლანეტაზე. ბევრი მეცნიერი ამბობს, რომ დედამიწა დიდი ხნის წინ გაცივდებოდა და ქვად გადაიქცეოდა, მწვანე პლანეტაზე ამდენი წყლის არსებობა რომ არა.

წყლის თვისებები
წყალს ბევრი ძალიან საინტერესო თვისება აქვს.
მაგალითად, წყალი ჰაერის შემდეგ ყველაზე მოძრავი ნივთიერებაა. სკოლის კურსიდან ბევრს ალბათ ახსოვს ისეთი კონცეფცია, როგორიცაა წყლის ციკლი ბუნებაში. მაგალითად: ნაკადი აორთქლდება პირდაპირი მზის გავლენით და გადაიქცევა წყლის ორთქლად. გარდა ამისა, ეს ორთქლი გადააქვთ სადღაც ქარით, გროვდება ღრუბლებში, ან თუნდაც მთებში თოვლის, სეტყვის ან წვიმის სახით. გარდა ამისა, ნაკადი ისევ ეშვება მთებიდან, ნაწილობრივ აორთქლდება. და ასე - წრეში - ციკლი მილიონჯერ მეორდება.
წყალს ასევე აქვს ძალიან მაღალი სითბოს ტევადობა. სწორედ ამის გამო ხდება წყლის ობიექტები, განსაკუთრებით ოკეანეები, ძალიან ნელა გრილდება თბილი სეზონიდან ან დღის დროიდან ცივზე გადასვლისას. პირიქით, ჰაერის ტემპერატურის მატებასთან ერთად წყალი ძალიან ნელა თბება. ამის გამო, როგორც ზემოთ აღინიშნა, წყალი ასტაბილურებს ჰაერის ტემპერატურას მთელ ჩვენს პლანეტაზე.
ვერცხლისწყლის შემდეგ წყალს აქვს ყველაზე მაღალი ზედაპირული დაძაბულობა. შეუძლებელია არ შეამჩნიოთ, რომ ბრტყელ ზედაპირზე შემთხვევით დაღვრილი წვეთი ზოგჯერ შთამბეჭდავი ლაქა ხდება. ეს აჩვენებს წყლის სიბლანტეს. კიდევ ერთი თვისება ჩნდება, როდესაც ტემპერატურა ოთხ გრადუსამდე ეცემა. მას შემდეგ, რაც წყალი ამ მომენტამდე გაცივდება, ის უფრო მსუბუქი ხდება. ამიტომ, ყინული ყოველთვის ცურავს წყლის ზედაპირზე და გამკვრივდება ქერქში, ფარავს მდინარეებსა და ტბებს. ამის წყალობით, თევზი არ იყინება წყალსაცავებში, რომლებიც ზამთარში იყინება.
წყალი, როგორც ელექტროენერგიის გამტარი
პირველ რიგში, თქვენ უნდა გაიგოთ რა არის ელექტრული გამტარობა (წყლის ჩათვლით). ელექტრული გამტარობა არის ნივთიერების უნარი, გაატაროს ელექტრული დენი თავის მეშვეობით. შესაბამისად, წყლის ელექტრული გამტარობა არის წყლის უნარი, გაატაროს დენი. ეს უნარი პირდაპირ დამოკიდებულია სითხეში არსებული მარილებისა და სხვა მინარევების რაოდენობაზე. მაგალითად, გამოხდილი წყლის ელექტრული გამტარობა თითქმის მინიმუმამდეა დაყვანილი იმის გამო, რომ ასეთი წყალი იწმინდება სხვადასხვა დანამატებისგან, რომლებიც ასე აუცილებელია კარგი ელექტროგამტარობისთვის. დენის შესანიშნავი გამტარია ზღვის წყალი, სადაც მარილების კონცენტრაცია ძალიან მაღალია. ელექტრული გამტარობა ასევე დამოკიდებულია წყლის ტემპერატურაზე. რაც უფრო მაღალია ტემპერატურა, მით მეტია წყლის ელექტრული გამტარობა. ეს ნიმუში გამოვლინდა ფიზიკოსების მრავალი ექსპერიმენტით.

წყლის გამტარობის გაზომვა
არსებობს ასეთი ტერმინი - კონდუქტომეტრია. ასე ჰქვია ელექტროქიმიური ანალიზის ერთ-ერთ მეთოდს, რომელიც დაფუძნებულია ხსნარების ელექტროგამტარობაზე. ეს მეთოდი გამოიყენება ხსნარებში მარილების ან მჟავების კონცენტრაციის დასადგენად, აგრეთვე ზოგიერთი სამრეწველო ხსნარის შემადგენლობის გასაკონტროლებლად. წყალს აქვს ამფოტერული თვისებები. ანუ, პირობებიდან გამომდინარე, მას შეუძლია გამოავლინოს როგორც მჟავე, ასევე ძირითადი თვისებები - იმოქმედოს როგორც მჟავა, ასევე ფუძე.
ამ ანალიზისთვის გამოყენებულ მოწყობილობას ძალიან მსგავსი სახელი აქვს - გამტარობის მრიცხველი. გამტარებლის გამოყენებით იზომება ელექტროლიტების ელექტროგამტარობა ანალიზში. ალბათ ღირს კიდევ ერთი ტერმინის ახსნა - ელექტროლიტი. ეს არის ნივთიერება, რომელიც დაშლისას ან დნობისას იშლება იონებად, რის გამოც შემდგომში ხდება ელექტრული დენი. იონი არის ელექტრულად დამუხტული ნაწილაკი. სინამდვილეში, გამტარი, წყლის ელექტრული გამტარობის გარკვეული ერთეულების საფუძველზე, განსაზღვრავს მის სპეციფიკურ ელექტროგამტარობას. ანუ ის განსაზღვრავს საწყის ერთეულად აღებული წყლის კონკრეტული მოცულობის ელექტრულ გამტარობას.
ჯერ კიდევ გასული საუკუნის სამოცდაათიანი წლების დასაწყისამდე, საზომი ერთეული "mo" გამოიყენებოდა ელექტროენერგიის გამტარობის აღსანიშნავად; ეს იყო სხვა სიდიდის წარმოებული - Ohm, რომელიც არის წინააღმდეგობის ძირითადი ერთეული. ელექტრული გამტარობა არის წინააღმდეგობის უკუპროპორციული რაოდენობა. ახლა ის იზომება Siemens-ში. ამ რაოდენობამ მიიღო სახელი გერმანიის ფიზიკოსის - ვერნერ ფონ სიმენსის პატივსაცემად.
სიმენსი
Siemens (შეიძლება დასახელდეს Cm ან S) არის Ohm-ის ორმხრივი, რომელიც არის ელექტრული გამტარობის საზომი ერთეული. ერთი სმ უდრის ნებისმიერ გამტარს, რომლის წინაღობა 1 ომს შეადგენს. Siemens გამოიხატება ფორმულით:
- 1 სმ = 1: Ohm = A: B = კგ −1 მ −2 s³A², სადაც
A - ამპერი,
V - ვოლტი.

წყლის თბოგამტარობა
ახლა მოდით ვისაუბროთ ნივთიერების თერმული ენერგიის გადაცემის უნარზე. ფენომენის არსი მდგომარეობს იმაში, რომ ატომებისა და მოლეკულების კინეტიკური ენერგია, რომლებიც განსაზღვრავენ მოცემული სხეულის ან ნივთიერების ტემპერატურას, მათი ურთიერთქმედების დროს გადადის სხვა სხეულში ან ნივთიერებაში. სხვა სიტყვებით რომ ვთქვათ, თბოგამტარობა არის სითბოს გაცვლა სხეულებს, ნივთიერებებს, ასევე სხეულსა და ნივთიერებას შორის.
წყლის თბოგამტარობა ასევე ძალიან მაღალია. ადამიანები წყლის ამ თვისებას ყოველდღიურად იყენებენ, შეუმჩნევლად. მაგალითად, კონტეინერში ცივი წყლის ჩასხმა და მასში სასმელების ან საკვების გაგრილება. ცივი წყალი ბოთლიდან ან კონტეინერიდან იღებს სითბოს, სანაცვლოდ სიცივეს აძლევს; საპირისპირო რეაქციაც შესაძლებელია.
ახლა იგივე ფენომენი მარტივად შეიძლება წარმოიდგინოთ პლანეტარული მასშტაბით. ოკეანე ზაფხულში თბება, შემდეგ კი, ცივი ამინდის დადგომასთან ერთად, ნელ-ნელა კლებულობს და სითბოს აწვდის ჰაერს, რითაც ათბობს კონტინენტებს. ზამთარში გაცივების შემდეგ, ოკეანე ხმელეთთან შედარებით ძალიან ნელა იწყებს დათბობას და თავის სიგრილეს თმობს ზაფხულის მზეში ჩაძირულ კონტინენტებს.

წყლის სიმკვრივე
ზემოთ აღწერილი იყო, რომ თევზი ზამთარში ცხოვრობს აუზში, იმის გამო, რომ წყალი გამკვრივდება ქერქში მთელ მათ ზედაპირზე. ჩვენ ვიცით, რომ წყალი იწყებს ყინულში გადაქცევას ნულოვანი გრადუსის ტემპერატურაზე. იმის გამო, რომ წყლის სიმკვრივე აღემატება მის სიმკვრივეს, ის ცურავს და იყინება ზედაპირზე.
წყლის თვისებები
ასევე, სხვადასხვა პირობებში, წყალი შეიძლება იყოს როგორც ჟანგვის აგენტი, ასევე შემცირების აგენტი. ანუ წყალი, რომელიც ტოვებს ელექტრონებს, ხდება დადებითად დამუხტული და იჟანგება. ან იძენს ელექტრონებს და ხდება უარყოფითად დამუხტული, რაც იმას ნიშნავს, რომ აღდგება. პირველ შემთხვევაში წყალი იჟანგება და მას მკვდარი ეწოდება. მას აქვს ძალიან ძლიერი ბაქტერიციდული თვისებები, მაგრამ თქვენ არ გჭირდებათ მისი დალევა. მეორე შემთხვევაში წყალი ცოცხალია. ის აძლიერებს, ასტიმულირებს ორგანიზმს გამოჯანმრთელებაში და ენერგიას მოაქვს უჯრედებს. განსხვავება წყლის ამ ორ თვისებას შორის გამოიხატება ტერმინით „დაჟანგვა-აღდგენითი პოტენციალი“.

რასთან შეუძლია წყალს რეაგირება?
წყალს შეუძლია რეაგირება მოახდინოს დედამიწაზე არსებულ თითქმის ყველა ნივთიერებასთან. ერთადერთი ის არის, რომ ეს რეაქციები რომ მოხდეს, თქვენ უნდა უზრუნველყოთ შესაფერისი ტემპერატურა და მიკროკლიმატი.
მაგალითად, ოთახის ტემპერატურაზე წყალი კარგად რეაგირებს ლითონებთან, როგორიცაა ნატრიუმი, კალიუმი, ბარიუმი - მათ აქტიურს უწოდებენ. ჰალოგენებით - ეს არის ფტორი, ქლორი. როდესაც თბება, წყალი კარგად რეაგირებს რკინასთან, მაგნიუმთან, ნახშირთან და მეთანთან.
სხვადასხვა კატალიზატორების დახმარებით წყალი რეაგირებს კარბოქსილის მჟავების ამიდებთან და ეთერებთან. კატალიზატორი არის ნივთიერება, რომელიც, როგორც ჩანს, უბიძგებს კომპონენტებს ურთიერთრეაქციისკენ, აჩქარებს მას.
არის თუ არა წყალი დედამიწის გარდა სხვაგან?
ამ დრომდე მზის სისტემის არც ერთ პლანეტაზე წყალი არ აღმოაჩინეს დედამიწის გარდა. დიახ, ისინი ვარაუდობენ მის არსებობას ისეთი გიგანტური პლანეტების თანამგზავრებზე, როგორიცაა იუპიტერი, სატურნი, ნეპტუნი და ურანი, მაგრამ ჯერჯერობით მეცნიერებს ზუსტი მონაცემები არ აქვთ. არსებობს კიდევ ერთი ჰიპოთეზა, რომელიც ჯერ ბოლომდე არ არის დამოწმებული, პლანეტა მარსის და დედამიწის თანამგზავრზე, მთვარეზე მიწისქვეშა წყლების შესახებ. მარსთან დაკავშირებით, ზოგადად არაერთი თეორია წამოიჭრა, რომ ოდესღაც ამ პლანეტაზე ოკეანე არსებობდა და მისი შესაძლო მოდელი მეცნიერებმაც კი დააპროექტეს.

მზის სისტემის გარეთ ბევრი დიდი და პატარა პლანეტაა, სადაც, მეცნიერთა აზრით, შესაძლოა იყოს წყალი. მაგრამ ჯერჯერობით არ არის ოდნავი შესაძლებლობა, რომ დარწმუნებული ვიყოთ ამაში.
როგორ გამოიყენება წყლის თერმული და ელექტრული გამტარობა პრაქტიკული მიზნებისთვის
იმის გამო, რომ წყალს აქვს მაღალი სითბოს ტევადობა, იგი გამოიყენება გათბობის მაგისტრალებში, როგორც გამაგრილებელი. ის უზრუნველყოფს სითბოს გადაცემას მწარმოებლიდან მომხმარებელზე. ბევრი ატომური ელექტროსადგური ასევე იყენებს წყალს, როგორც შესანიშნავი გამაგრილებელი.
მედიცინაში ყინულს იყენებენ გასაციებლად, ხოლო ორთქლს დეზინფექციისთვის. ყინული ასევე გამოიყენება საზოგადოებრივი კვების სისტემაში.
ბევრ ბირთვულ რეაქტორში წყალი გამოიყენება როგორც მოდერატორი ბირთვული ჯაჭვური რეაქციის წარმატებული წარმოქმნის უზრუნველსაყოფად.
ზეწოლის ქვეშ წყალი გამოიყენება ქანების გაყოფის, მსხვრევისა და ჭრისთვისაც კი. იგი აქტიურად გამოიყენება გვირაბების, მიწისქვეშა შენობების, საწყობებისა და მეტროს მშენებლობაში.
დასკვნა
სტატიიდან გამომდინარეობს, რომ წყალი თავისი თვისებებითა და ფუნქციებით ყველაზე შეუცვლელი და საოცარი ნივთიერებაა დედამიწაზე. არის თუ არა დამოკიდებული დედამიწაზე ადამიანის ან სხვა ცოცხალი არსების სიცოცხლე წყალზე? Რათქმაუნდა დიახ. ეს ნივთიერება ხელს უწყობს ადამიანის სამეცნიერო საქმიანობას? დიახ. აქვს თუ არა წყალს ელექტროგამტარობა, თბოგამტარობა და სხვა სასარგებლო თვისებები? პასუხი ასევე არის "დიახ". სხვა საქმეა, რომ დედამიწაზე სულ უფრო ნაკლები წყალია და განსაკუთრებით სუფთა წყალი. და ჩვენი ამოცანაა შევინარჩუნოთ და დავიცვათ იგი (და შესაბამისად ყველა ჩვენგანი) გადაშენებისგან.
გაკვეთილის მიზანი.ქიმიური ელემენტისა და მარტივი ნივთიერების შესახებ ცოდნის კონკრეტიზაცია. შეისწავლეთ ჟანგბადის ფიზიკური თვისებები. შეიმუშავეთ იდეები ლაბორატორიაში ჟანგბადის წარმოებისა და შეგროვების მეთოდების შესახებ.
Დავალებები:
- საგანმანათლებლო:
- შეძლოს ერთმანეთისგან განასხვავოს ცნებები "ქიმიური ელემენტი" და "მარტივი ნივთიერება"
მაგალითად ჟანგბადის გამოყენებით.
– შეძლოს ჟანგბადის ფიზიკური თვისებების და მეთოდების დახასიათება
ჟანგბადის შეგროვება.
– შეძლოს კოეფიციენტების განთავსება რეაქციის განტოლებებში. - საგანმანათლებლო:
ლაბორატორიული ექსპერიმენტების ჩატარებისას სიზუსტის ფორმირება;
ყურადღება, მზრუნველი დამოკიდებულება. - საგანმანათლებლო:
– სამშენებლო ლოგიკური ჯაჭვების ფორმირება, ქიმიის დაუფლება
ტერმინოლოგია, შემეცნებითი აქტივობა, დასკვნები და განსჯა.
Ძირითადი ცნებები.ქიმიური ელემენტი, მარტივი ნივთიერება, ფიზიკური თვისებები, კატალიზატორები.
დაგეგმილი სწავლის შედეგები.შეძლოს ერთმანეთისგან განასხვავოს ცნებები „ქიმიური ელემენტი“ და „მარტივი ნივთიერება“ ჟანგბადის მაგალითის გამოყენებით. შეძლოს ჟანგბადის ფიზიკური თვისებების და ჟანგბადის შეგროვების მეთოდების დახასიათება. შეძლოს კოეფიციენტების განთავსება რეაქციის განტოლებებში.
გამოცდილება:წყალბადის ზეჟანგიდან ჟანგბადის მიღება და მისი არსებობის დადასტურება.
დემონსტრაციები.ჟანგბადის მიღება კალიუმის პერმანგანატისგან. ჟანგბადის შეგროვება ჰაერის გადაადგილების მეთოდით და მისი არსებობის დადასტურება.
აღჭურვილობა და რეაგენტები:მენდელეევის ცხრილი, მასალა (ტესტი), მოწყობილობა კალიუმის პერმანგატიდან ჟანგბადის წარმოებისთვის (კონუსური კოლბა რეზინის საცობით, გაზის გამომავალი მილი, PKh-12, სამფეხა, ფეხი, ბამბა), წყალბადის ზეჟანგი 20 მლ (15 ბოთლი), მანგანუმი (IV) ოქსიდი (15 ბოთლი), გამანაწილებელი კოვზი (15 ც.), სპირტის ნათურა (15 ც.), ასანთი (15 ც.), ნატეხი (15 ც.), კალიუმის პერმანგანატი (5 გ).
გაკვეთილის ტიპი:ახალი ცოდნის შესწავლის გაკვეთილი.
სწავლების მეთოდები:
- ახსნა-განმარტებით-ილუსტრაციული (ვერბალური: საუბარი, პრეზენტაცია; ვერბალურ-ვიზუალური: მოსწავლეთა დამოუკიდებელი მუშაობა თვალსაჩინოებით; ვერბალურ-ვიზუალური-პრაქტიკული: მოსწავლეთა მუშაობა დარიგებებით, ქიმიური ექსპერიმენტის ჩატარება, დამოუკიდებელი წერილობითი სამუშაოს შესრულება).
- ნაწილობრივი ძიების (ევრისტიკული) მეთოდი (ვერბალური: საუბარი-დისკუსია; ვერბალურ-ვიზუალური: დისკუსია თვალსაჩინოების დემონსტრირებით, მოსწავლეთა დამოუკიდებელი მუშაობა თვალსაჩინოებით; ვერბალურ-ვიზუალური-პრაქტიკული: მოსწავლეთა მუშაობა დარიგებებით, ქიმიური ექსპერიმენტის ჩატარება, შესრულება. დამოუკიდებელი წერითი სამუშაო).
- კვლევის მეთოდი (ვერბალურ-ვიზუალურ-პრაქტიკული: კვლევითი ქიმიური ექსპერიმენტის ჩატარება).
საქმიანობის ორგანიზების ფორმები:ფრონტალური, ჯგუფური (ორთქლის ოთახი).
I. საორგანიზაციო ეტაპი.
- სალამი.
- დაუსწრებელთა განმარტება.
- გაკვეთილისთვის მზადყოფნის შემოწმება.
დღიურის, საკლასო რვეულის, ქიმიის სახელმძღვანელოს, კალმის ხელმისაწვდომობა.
II. მოსწავლეების მომზადება ახალი მასალის აქტიური და შეგნებული სწავლისთვის.
მასწავლებელი:დღევანდელი გაკვეთილის თემის დასადგენად მე და შენ უნდა ამოხსნათ თავსატეხი?
სლაიდი 1
ამოხსენით თავსატეხი და გავიგებთ დღევანდელი გაკვეთილის თემას.
ბრინჯი. 1
(BRUSH) KI + (ELEPHANT) SLO + ROD
ჟანგბადი
მასწავლებელი:დღევანდელი გაკვეთილის თემა: „ჟანგბადი, მისი ზოგადი მახასიათებლები და გაჩენა ბუნებაში. ჟანგბადის ფიზიკური თვისებები. მიღება.”
სლაიდი 2
დღევანდელი გაკვეთილის თემა: „ჟანგბადი, მისი ზოგადი მახასიათებლები და გაჩენა ბუნებაში. ჟანგბადის ფიზიკური თვისებები. მიღება.”
სლაიდი 3
"ჟანგბადი" არის ნივთიერება, რომლის გარშემოც ტრიალებს მიწიერი ქიმია.
ჯ.ბერცელიუსი
მასწავლებელი:ქიმიის ენის გამოყენებით დაფაზე უნდა ჩაწეროთ: ჟანგბადი, როგორც ქიმიური ელემენტი და როგორც მარტივი ნივთიერება.
ჟანგბადი - როგორც ელემენტი - ო.
ჟანგბადი - როგორც მარტივი ნივთიერება - O 2.
მასწავლებელი:ახლა ეკრანზე გამოჩნდება რამდენიმე ფრაზა (გამონათქვამი), თქვენ უნდა დაადგინოთ, რა მნიშვნელობით არის ნახსენები მათში ჟანგბადი - როგორც ქიმიური ელემენტი თუ როგორც მარტივი ნივთიერება.
სლაიდი 4
ვარჯიში:განსაზღვრეთ ჟანგბადი, როგორც ქიმიური ელემენტი ან მარტივი ნივთიერება.
- ჟანგბადი სასიცოცხლოდ მნიშვნელოვანი ორგანული ნივთიერებების ნაწილია: ცილები, ცხიმები, ნახშირწყლები.
- დედამიწაზე არსებული ყველა ცოცხალი მატერია ჟანგბადს სუნთქავს.
- ჟანგი შეიცავს რკინას და ჟანგბადს.
- თევზი წყალში გახსნილ ჟანგბადს სუნთქავს.
- ფოტოსინთეზის დროს მწვანე მცენარეები ათავისუფლებენ ჟანგბადს.
მასწავლებელი:თქვენ გჭირდებათ PSHE-ს დახმარებით ისინი. D.I. მენდელეევი ახასიათებს ქიმიურ ელემენტს "ჟანგბადი", შემდეგი გეგმის მიხედვით:
სლაიდი 5:
- Სერიული ნომერი -
- ფარდობითი ატომური მასა -
- პერიოდი -
- ჯგუფი -
- ქვეჯგუფი -
- ვალენტობა -
მასწავლებელი:მოდით შევამოწმოთ, ყურადღება მიაქციეთ ეკრანს
სლაიდი 6
- სერიული ნომერი – 8
- ფარდობითი ატომური მასა – Ar(O) = 16
- პერიოდი - მეორე
- ჯგუფი – VI
- ქვეჯგუფი - a (მთავარი)
- ვალენტობა – II
სლაიდი 7
ჟანგბადის განაწილება ბუნებაში:
პირველი ადგილი გავრცელებით დედამიწის ქერქში, ე.ი. ლითოსფერო, იკავებს ჟანგბადს - 49%, შემდეგ მოდის სილიციუმი - 26%, ალუმინი - 7%, რკინა - 5%, კალციუმი - 4%, ნატრიუმი - 2%, კალიუმი - 2%, მაგნიუმი - 2%, წყალბადი - 1%.
IN ბიოსფეროცოცხალი ორგანიზმების მასის დაახლოებით 65% არის ჟანგბადი.
IN ჰიდროსფეროის 89%-ს შეადგენს.
IN ატმოსფერო: 23% წონით, 21% მოცულობით.

ბრინჯი. 2
მასწავლებელი:თქვენ გჭირდებათ PSHE-ს დახმარებით ისინი. დ.ი.მენდელეევი ახასიათებს მარტივ ნივთიერებას "ჟანგბადი".
ასე რომ, როგორია მარტივი ნივთიერების ქიმიური ფორმულა - 0 2
ფარდობითი მოლეკულური წონა Mg(0 2) = 32
სლაიდი 8
ჟანგბადის აღმოჩენის ისტორია.
 ბრინჯი. 3
ნახ 5 |
 ბრინჯი. 4
ბრინჯი. 6 |
მასწავლებელი კომენტარს აკეთებს: 1750 წელს მ.ვ. ლომონოსოვმა ჩაატარა ექსპერიმენტები და დაამტკიცა, რომ ჰაერი შეიცავს ნივთიერებას, რომელიც ჟანგავს ლითონს. დაუძახა მას ფლოგისტონი.
კარლ შელემ მიიღო ჟანგბადი 1771 წელს. დამოუკიდებლად ჟანგბადი მიიღო ჯ.პრისტლიმ 1774 წელს.
და ამბავი მარტივია...
ერთხელ ჯოზეფ პრისტლი
ვერცხლისწყლის ოქსიდის გათბობა
უცნაური გაზი აღმოვაჩინე.
გაზი ფერის გარეშე, სახელის გარეშე,
მასში სანთელი უფრო კაშკაშა იწვის.
საზიანო არ არის სუნთქვა?
ექიმისგან ვერ გაიგებთ!
კოლბიდან ახალი გაზი გამოვიდა -
მას არავინ იცნობს.
თაგვები ამ გაზს სუნთქავენ
შუშის საფარის ქვეშ.
ხალხიც სუნთქავს...
1775 წელს ა. ლავუაზიემ დაადგინა, რომ ჟანგბადი არის ჰაერის კომპონენტი და გვხვდება ბევრ ნივთიერებაში.
ბუნებამ შექმნა სამყარო ატომებისგან:
ორმა მსუბუქმა ატომმა მიიღო წყალბადი,
დაემატა ჟანგბადის ერთი ატომი -
და აღმოჩნდა, რომ ეს იყო წყლის ნაწილაკი,
წყლის ზღვა, ოკეანეები და ყინული...
ჟანგბადი გახდა
თითქმის ყველგან არის შევსება.
სილიკონით ის ქვიშის მარცვლად იქცა.
ჰაერში ჟანგბადი შევიდა
გასაკვირია,
ოკეანის ლურჯი სიღრმიდან.
და მცენარეები გაჩნდნენ დედამიწაზე.
ცხოვრება გამოჩნდა:
სუნთქვა, წვა...
პირველი ფრინველები და პირველი ცხოველები,
პირველი ხალხი, ვინც გამოქვაბულში ცხოვრობდა...
ცეცხლი წარმოიქმნა ხახუნის შედეგად,
თუმცა ხანძრის გამომწვევი მიზეზი არ იცოდნენ.
ჟანგბადის როლი ჩვენს დედამიწაზე
დიდი ლავუაზიე მიხვდა.
მასწავლებელი:ახლა ექსპერიმენტულად გავეცნოთ ჟანგბადს. ვინაიდან ჩვენ ვიყენებთ გამათბობელ მოწყობილობას (ალკოჰოლური ნათურა), აუცილებელია ტუბერკულოზის დამახსოვრება ალკოჰოლურ ნათურთან მუშაობისას:
- ალკოჰოლური ნათურის გამოყენებისას არ უნდა აანთოთ ის სხვა სპირტიანი ნათურიდან, რადგან ალკოჰოლმა შეიძლება დაიღვაროს და გამოიწვიოს ცეცხლი.
- ალკოჰოლური ნათურის ალი რომ ჩააქროთ იგი თავსახურით უნდა დაიხუროს.
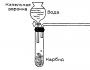
ჩაასხით H2O2 (წყალბადის ზეჟანგი) ხსნარი ჭიქაში.
აანთეთ ალკოჰოლური ნათურა, მოათავსეთ ჩირაღდანი ცეცხლში და ჩააქრეთ ჩირაღდანი. შემდეგ ჩაამატეთ მანგანუმის (IV) ოქსიდი ჭიქაში და ჩამქრალი ნატეხი დაადეთ ჭიქაში - რა შეიმჩნევა?
Სტუდენტი:ჩირაღდანი ანათებს. ამ გზით დავადგინეთ, რომ ჭიქაში არის ჟანგბადი.
მასწავლებელი:ამ ექსპერიმენტში მანგანუმის (IV) ოქსიდი არის კატალიზატორი - ნივთიერება, რომელიც აჩქარებს ქიმიური რეაქციის პროცესს, მაგრამ არ მოიხმარება.
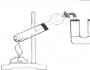
საჩვენებელი ექსპერიმენტი:"ჟანგბადის წარმოება კალიუმის პერმანგანატისგან."
ჩვენ ვაწყობთ მოწყობილობას.
ჩვენ ვაგროვებთ ჟანგბადს ჰაერის კონუსურ კოლბაში გადატანით, გარკვეული პერიოდის შემდეგ ვამოწმებთ ჟანგბადის არსებობას მდნარი ნატეხის გამოყენებით; თუ ის აალდება, მაშინ საკმარისი რაოდენობით ჟანგბადი შეგროვდა.
ვხურავთ რეზინის საცობით და ვათავსებთ ამწე მაგიდაზე.
და ვიწვევთ მოსწავლეებს დაახასიათონ ჟანგბადის ფიზიკური თვისებები შემდეგი კრიტერიუმების მიხედვით.
სლაიდი 9
- აგრეგაციის მდგომარეობა -...
- ფერი -...
- სუნი -...
- წყალში ხსნადობა -...
- ტო კიპ. –...
- Ელექტრო გამტარობის -...
- თბოგამტარობა -...
- უფრო მძიმე ან მსუბუქი ვიდრე ჰაერი
მასწავლებელი:მოდით შევამოწმოთ, ყურადღება მიაქციეთ ეკრანს.
სლაიდი 10
- ფიზიკური მდგომარეობა - გაზი.
- ფერი - ფერი არ არის
- სუნი - სუნი არ აქვს
- წყალში ხსნადობა - ცუდად ხსნადი
- თ° ადუღეთ. – 183°С
- ელექტრული გამტარობა - არაგამტარი
- თბოგამტარობა - ცუდად ატარებს სითბოს (ცუდი)
- ჰაერზე მძიმე
მასწავლებელი:მოსწავლეებს ვუსვამთ პრობლემურ კითხვას: რატომ არის ნახატზე ჟანგბადი ლურჯი სითხის სახით?
სლაიდი 11

ბრინჯი. 7
მოსწავლის პასუხი (დაამატა მასწავლებელმა):ეს ჟანგბადი თხევად მდგომარეობაშია, ხოლო თხევადი ჟანგბადი ლურჯია.
ახლა შევაჯამოთ და ჩავწეროთ რვეულში ჟანგბადის გამომუშავების სხვადასხვა გზები, რომლებიც დღეს დავაკვირდით.
ბრინჯი. 8

ბრინჯი. 9
მასწავლებელი:გაკვეთილის ბოლოს ვამოწმებთ ჩვენს ცოდნას.
Გავიცნოთ:
საგანი: ქიმია;
მარტივი და რთული ნივთიერებები;
ნივთიერებების თვისებები;
ქიმიური ელემენტის არსებობის ფორმები
Ქიმია- მეცნიერება ნივთიერებების, მათი თვისებების, ნივთიერებების გარდაქმნებისა და ამ გარდაქმნების კონტროლის მეთოდების შესახებ
ჩამოტვირთვა:
გადახედვა:
პრეზენტაციის გადახედვის გამოსაყენებლად შექმენით Google ანგარიში და შედით მასში: https://accounts.google.com
სლაიდის წარწერები:
ქიმიის საგანი. ნივთიერებები.
www.pmedia.ru გაკვეთილის დევიზი: „ქიმია ფართოდ სწვდის ხელებს ადამიანურ საქმეებში“ M.V. ლომონოსოვი
გაკვეთილის მიზანი: გაცნობა: -ქიმიის საგანი; - მარტივი და რთული ნივთიერებები; - ნივთიერებების თვისებები; -ქიმიური ელემენტის არსებობის ფორმები.
1. ო.ს.გაბრიელიანი. "Ქიმია". მე-8 კლასი. სახელმძღვანელო. 2. რვეული კლასში და სახლში სამუშაოდ. 3. რვეულები ტესტებისა და პრაქტიკული სამუშაოებისთვის. რა არის საჭირო გაკვეთილისთვის? Უსაფრთხოების ზომები!
საბუნებისმეტყველო მეცნიერებები 1. რა მეცნიერებები შეისწავლის ბუნებას? 2. რას სწავლობს ბიოლოგია; ფიზიკა; გეოგრაფია; ასტრონომია; გეოლოგია? 3. რატომ დაიწყეთ მე-7 კლასში ფიზიკის, მე-8 კლასში ქიმიის სწავლა?
რას სწავლობს ქიმია? ქიმიის შესწავლა ნივთიერებების თვისებები ნივთიერებების ტრანსფორმაციები "ქიმიის მამა" რობერტ ბოილი (1627 - 1691)
ქიმია არის მეცნიერება ნივთიერებების, მათი თვისებების, ნივთიერებების გარდაქმნებისა და ამ გარდაქმნების კონტროლის მეთოდების შესახებ სხეულის ნივთიერების მოლეკულები ატომები.
ნივთიერება არის ის, რისგანაც შედგება ფიზიკური სხეულები.ქიმიური ელემენტი არის ატომის გარკვეული სახეობა.ნივთიერებები ბუნებრივი (ნახშირორჟანგი) სინთეტური (პოლიეთილენი) ნივთიერებები მარტივი (წყალბადი, ჟანგბადი) რთული (წყალი, შაქარი)
განვიხილოთ მოლეკულების მოდელები. რა მსგავსება და განსხვავებაა მათ შორის? რომელი ნივთიერებაა მარტივი და რომელი რთული? რატომ? ნივთიერებები ნივთიერება წყალბადი ჟანგბადი წყალი
ნივთიერებებს, რომლებიც წარმოიქმნება ერთი ქიმიური ელემენტის ატომებით, მარტივი ეწოდება
ნივთიერებებს, რომლებიც წარმოიქმნება სხვადასხვა ქიმიური ელემენტების ატომებით, კომპლექსური ეწოდება
სავარჯიშო No1 დაადგინეთ შემოთავაზებული ნივთიერებებიდან რომელია მარტივი და რომელი რთული.
რა აერთიანებს ამ ობიექტებს?
ნივთიერებები და სხეულები
ნივთიერებები და სხეულები
ნივთიერების თვისებები არის ნიშნები, რომლებითაც ნივთიერებები განსხვავდებიან ან ერთმანეთის მსგავსია.ქიმიის საგანია ნივთიერებების შესწავლა, მათი გარდაქმნები, მოცემული თვისებების მქონე ნივთიერებების შექმნა.ქიმიის განაცხადის შედგენილობის თვისებები.
სავარჯიშო No2 მიუთითეთ სად არის საუბარი ჟანგბადზე, როგორც ქიმიურ ელემენტზე და სად - როგორც მარტივ ნივთიერებაზე: ა) ჟანგბადი წყალში ოდნავ ხსნადია; ბ) წყლის მოლეკულები შედგება ორი წყალბადის ატომისა და ერთი ჟანგბადის ატომისგან; გ) ჰაერი შეიცავს 21% ჟანგბადს (მოცულობით); დ) ჟანგბადი ნახშირორჟანგის ნაწილია.
მატერიის ფიზიკური თვისებების აღწერის გეგმა 1. აგრეგაციის რა მდგომარეობაში - აირისებრი, თხევადი თუ მყარი - იმყოფება ნივთიერება მოცემულ პირობებში? 2. რა ფერისაა ნივთიერება? აქვს ბრწყინავს? 3. აქვს თუ არა ნივთიერებას სუნი? 4. ავლენს თუ არა ნივთიერება პლასტიურობას, მტვრევადობას ან ელასტიურობას? 5. იხსნება თუ არა ნივთიერება წყალში? 6. რა არის ნივთიერების დნობის და დუღილის წერტილი? (იხილეთ საცნობარო წიგნები.) 7. რა არის ნივთიერების სიმკვრივე? (იხილეთ საცნობარო წიგნები.) 8. აქვს თუ არა ნივთიერებას თერმული და ელექტრული გამტარობა? (იხილეთ საცნობარო წიგნები.)
სავარჯიშო No3 აღწერეთ ძმარმჟავას, შაქრის, მარილის, სპილენძის, ალუმინის ფიზიკური თვისებები შემოთავაზებული გეგმის მიხედვით. (გვ.5 (21) სახელმძღვანელო)
ქიმია და გარემოს დაცვა აუცილებელია ბუნების დაცვა და შენარჩუნება!
საშინაო დავალება პუნქტი 1, მაგ. 1-4 მოხსენებები, პრეზენტაციები ქიმიის განვითარების ისტორიის შესახებ ცხრილი თარიღი მეცნიერების მიღწევები